Bíró Szabolcs állításából ezt szűrheti le az olvasó:
A B6-vitamin pótlás egyetlen megfelelő formája a piridoxal-5-foszfát (PLP), a többi forma kerülendő.
Bíró Szabolcs indoklása:
Arra, hogy miért egyedül a PLP forma lenne jó és miért kerülendő a többi, nincs semmiféle indoklás, csak többször ki van emelve. Azonban arra, hogy miért a PLP a preferált B6 forma, van indoklás és referencia is. Az indoklás szerint a PLP már a kész „aktív” koenzim formája a B6-vitaminnak, így annak már nem kell átalakulnia, az biztosan felszívódik, míg a többi formának egy vagy két lépésben még át kell alakulnia PLP-vé. Az említett referencia, ami meg van adva a könyvben, egy 1990-ben megjelent szakcikk,[4] amely azonban világosan leírja ennek az ellenkezőjét. Azt, hogy a PLP-nek előbb piridoxálra (PL) kell bomlania, hogy felszívódhasson, majd később az alakul vissza PLP-vé, tehát minimum két lépésre van szüksége a szájon át bevett PLP-nek, amíg sejten belüli PLP-vé válik és nem képes közvetlenül felszívódni. Hátrányban van az egyszerű szabad formákkal szemben, nem előnyben. A referenciának megadott szakcikkben le van írva az is, hogy milyen lépések mennek végbe a májban, míg a B6-vitamin a különböző formáiból PLP-vé alakul. Ez a Vitaminipar könyvben úgy van kommunikálva, mintha a szájon át bevett B6-vitamin lépéseire vonatkozna és ebből jut a könyv arra a következtetésre, hogy a B6 pótlásnak a PLP a preferált módja. Majd később érthetetlen okokból végül azt a végkövetkeztetést vonja le, hogy a PLP az egyetlen megfelelő módja a B6-vitamin pótlásnak és a többi forma kerülendő. A megadott referenciában azt is írják, hogy 25 mg piridoxin (PN) kiegészítés normalizálta a B6-vitamin hiányt, és növelte a PLP szintjét, még súlyos májkárosodás (májcirrózis) esetén is, azaz remekül átalakult a PN PLP-vé.
Az én állításom:
A legmegfelelőbb módja a B6-vitamin pótlásának, ha vegyesen pótoljuk a piridoxal-5-foszfát (PLP) és a piridoxin-hidroklorid (PN-HCl) formát, azonban 25mg-ot meg nem haladó összmennyiségben. B2-vitamin megfelelő ellátottsága esetén feltehetően semmi előnye a PLP formának a PN-HCl felett, sőt még hátránya is lehet. B2-vitamin hiány esetében valóban egyértelműen a PLP forma a jobb, sőt olyankor csak az a jó, azonban ez nem ok a PLP preferálására, hiszen a legtöbb multivitamin/b-komplex bőven elég B2-t tartalmaz a B6 mellett. Létezik azonban még egy ok, ami miatt pusztán elővigyázatosságból, de fontosnak tartom, hogy PLP forma is jelen legyen a PN forma mellett, méghozzá jelentős mennyiségben, ahogyan arra is van legalább két ok, hogy ne csak PLP formába pótoljuk a B6-ot (ezekről bővebben az indoklásomban). Összességében az emberek nagy többsége számára mindkét forma tökéletes. a PLP és PN-HCl is (25mg-ig), de létezhetnek esetek, amikor a vegyes pótlásuk megfelelőbb, így általánosságban is vegyesen érdemes termékekbe integrálni a B6-ot, 25mg-ot meg nem haladó napi dózisban.
Az én indoklásom:
Élelmiszerekben a B6-vitamin 7 féle formában fordul elő: Piridoxin (PN), piridoxal (PL) és piridoxamin (PM) formájában, illetve ezek foszfoészter formáiban, azaz piridoxin-5-foszfát (PNP), piridoxal-5-foszfát (PLP) és piridoxamin-foszfát (PMP) formában, illetve előfordul még piridoxinsav (4-PA) formájában is. [1] Ezek mind PLP-vé alakulnak a sejtekben és „aktív” foszfoészter formáikban egyik sem tud felszívódni. [1,3,4,5] Állati élelmiszerekben főleg PL, PLP és 4-PA formában található, míg növényi élelmiszerekre mind a 7 forma jellemző. [3,5]
Étrend-kiegészítőkben az EU-ban csak a piridoxin és piridoxal használható. Előbbi só formájában (piridoxin-HCl, azaz PN-HCl) és foszfoészter formájában is (piridoxin-5-foszfát, azaz PNP) használható, míg utóbbi csak a foszfoészter formájában (piridoxal-5-foszfát, azaz PLP), ami mellesleg a sejten belüli aktív koenzim forma maga.
Legyen az élelmiszer vagy kiegészítő, a bevett foszfoészter formáknak (pl PLP) először át kell alakulniuk PN-é, PL-é vagy PM-vé, hogy fel tudjanak szívódni, sőt még utána, a sejtek is csak ezen egyszerű formáikban képesek őket felvenni jellemzően. Végül a sejtekben alakulnak át a végső aktív konenzim formáikká, PLP-vé. [1,2,3,4,5] Tehát, ahogy a B1, B2, B3, B5 esetében is láthattuk, itt is, bár az élelmi források is jellemzően a már aktív formáikat tartalmazzák, a hasznosulásuk csak a visszabontott legegyszerűbb formában tud megtörténi és a sejtekbe bejutva, ott épülnek föl belőlük az aktív koenzim formáik. Hiába szedjük be tehát a már aktív formáikat, azok csak 1 lépéssel hátrább vannak a végső céljuktól, a végső sejten belül aktív koenzimformává való alakulásuktól, hiába már maguk is azok… Ezzel szemben a só formáik, ahogy minden só, azonnal disszociálnak bármilyen folyadékban (pl. gyomrunkban lévő folyadékban) és szétesnek ionjaikra, azaz a már eleve felszívódni képes szabad formájukra. Ezért van minden sima, nem aktív B-vitamin forma legalább 1 lépéssel előrébb a már kész formáikhoz képest, mert ezeknek már nem kell előbb visszaalakulniuk, így éppen hogy ezek szívódnak fel biztosan, míg az aktív formáik bizonyos egészségügyi problémák, hiányállapotok esetén fellépő enzimhiányok miatt nem képesek megfelelően felszívódni (bővebben erről az előző B1, B2, B5 írásaimban). Bár a marketinganyagok az ellenkezőjével próbálják megvezetni a laikusokat, a szakirodalomban teljes a konszenzus ezen a téren: Az aktív koenzim B1/2/3/5/6 formák orális szedése 1 lépéssel hátrébb és nem előrébb van, mint a sima szabad/só formáik használata.
A B6-vitamin azonban részben kivétel a B-vitaminok közül ezen a téren (a B9-hez hasonlóan), itt ugyanis nem csak hátránnyal jár a már kész aktív forma használata, de előnnyel is. Miért?
A végső forma, amivé a sejtjeinkben alakulnia kell a bármiből származó B6-nak, a PLP. Nézzük végig, hogy melyik forma hogyan alakul végül PLP-vé… Ez történik velük a szájon át való elfogyasztásuk során (a piridoxamint és foszfoészterét, illetve a piridoxinsavat kihagyom a felsorolásból, mert kevéssé érinti a témát + ugyan az történik velük is, mint a többivel, melyek itt lényegesebbek):
Piridoxin (PN) A pridixin HCl sója lenyelés után a gyomorban azonnal szabad piridoxinná alakul, majd felszívódik a vékonybélben. Végül akár még a vékonybél sejtjeiben, akár a májban, akár más sejtekben átalakul piridoxin-5-foszfáttá (PNP) a piridoxin-kináz enzim révén, majd piridoxal-5-foszfáttá (PLP) a B2-vitamin függő PNPO enzim által. [1,2,3,4,5] Ez utóbbi átalakulás jellemzően a májban történik, ha magas a dózis.[4] A májból kikerült PLP a végső célsejtekbe való bejutás előtt lebomlik szabad piridoxállá (PL), majd visszaalakul PLP-vé bennük, szintén a PNPO enzim segítségével.[4]
A piridoxin-5-foszfát (PNP) 1 lépéssel nem előrébb, hanem hátrébb van ehhez képest (ellenkezőleg, mint ahogy a Vitaminipar című szerepel). Először ugyanis a PNP-nek szabad piridoxinná (PN) kell alakulni a vékonybélben, hogy ott felszívódhasson.[1,4,5] Miután PN-é alakult, onnantól kezdve nyilván ugyanaz lesz az átalakulásának és célsejtekbe jutásának folyamata, mint amit fentebb a PN esetében leírtam.
Piridoxal (PL) lenyelés után felszívódik, eljut a sejtekhez, ahol a piridoxin-kináz enzim révén PLP-vé alakul,[1,2,4] azaz ez valóban 1 lépéssel előrébb lenne a többinél, miközben hátránya semmilyen téren nem lenne, csak sajnos az EU-ban tiltott + nem ismerek a világon egyetlen terméket sem, ahol használnák, pedig létező alapanyag a piridoxal sója (piridoxal-hidroklorid), mely azonnal piridoxallá esik szét a gyomorban.
Piridoxal-5-foszfát (PLP) Először a vékonybelünkben lévő enzimeknek le kell bontania szabad PL-é, hogy felszívódhasson, majd a PL eljut a sejtekbe, ahol PLP-vé alakul, ahogy PL-nél leírtam. Ez tehát egyszerre van 1 lépéssel előrébb és 1lépéssel hátrébb, mint pl a piridoxin-hidroklorid, de 1lépéssel előrébb, mint a piridoxin-5-foszfát (PNP). [1-5]
Egy egyszerűsített kép a különböző formák enzimatikus átalakulásáról:[2]
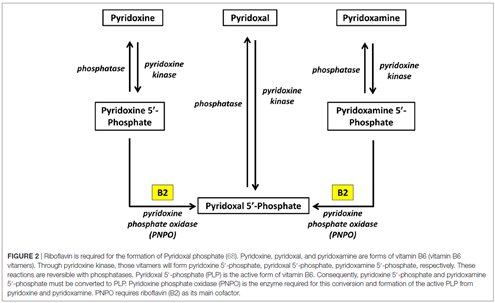
Láthatjuk tehát, hogy a PN (pl PN-HCl) annyival van előrébb a PLP-hez képest, hogy már egyből a B6 szabad formáját biztosítja, így az biztosan felszívódik, akkor is, ha nincs elég alkaikus-foszfatáz és egyéb enzim a bélben/vérben/stb, míg a PLP csak akkor tud hasznosulni, ha van elég ilyen enzim, amik lehasítják róla a foszfát-csoportot.[5] Miközben a PLP meg annyival van előrébb, hogy neki már nem kell átalakulnia a B2-vitamin függő PNPO enzim által PL-é, de ugyan úgy át kell alakulni a PLP-nek is PL-é majd vissza PLP-vé a piridoxin-kináz enzim által, ahogy a PN-nek is. [1-5] Összefoglalva tehát a PLP is 1 lépés hátrányban és 1 lépés előnyben van a piridoxin HCl-hez képest és fordítva is ez igaz. A piridoxin-hidroklorid előnye, hogy ő biztosan felszívódik, enzim készleteinktől és egészségi állapotunktól függetlenül, míg a PLP előnye, hogy neki nincs szüksége a B2 függő PNPO enzimre. Ez jellemzően annyit jelent, hogy B2 hiányban van előnye a PLP-ként való B6 pótlásnak, míg B2 megfelelő bevitele mellett a piridoxin-hidroklorid tűnik előnyösebbnek (és olcsóbb is) a PLP-nél.
Bár az EU-ban nem engedélyezett, létezik piridoxal-hidroklorid formája is a B6-nak, ez lenne a jobb, mint a PLP, ugyanis ez már szabad formáva alakul azonnal oldódáskor, azaz ehhez kell a legkevesebb enzim/átalakulás (sem foszfatáz enzimekre nincs szükség a felszívódásához, sem PNPO enzimre az átalakulásához. Csak a piridoxin-kináz szükséges hozzá a sejteken belül, ami viszont az összes formához szükséges). A legideálisabb a piridoxal-HCl és piridoxin HCl formák keveréke lenne.
Ha megfelelő B2 bevitel mellett a sima piridoxin is átalakul piridoxállá és olcsóbb is, mint a PLP, ami ráadásul bizonyos állapotokban fel sem szívódik, akkor mi értelme van mégis PLP forma használatának?
A B6-vitamin extrém nagy dózisainak hosszú távú használata esetén (500mg feletti napi dózisok esetén) észrevették ún. neuropátiás zavarok megjelenését, mely a végtagok érzékelésében bekövetkezett változásként jelent meg, pl zsibbadás vagy csökkent érzékelés, mint tünet. Ezek a tünetetek a nagy dózisú B6 szedésének abbahagyásával megszűntek. 100-500mg közti napi dózisok éveken át szedve sem okoztak semmiféle problémát vizsgálatokban, azonban léteznek esettanulmányok, ahol már 100mg-os vagy alatti B6 dózisok is ilyen átmeneti, enyhe neuropátiás zavarokat váltottak ki. Fontos megjegyezni, hogy nagyon ritkán megjelenő problémáról van szó, alig pár eset ismert, miközben emberek milliói szedik nagy dózisban a B6-ot. Azonban nem kizárható, hogy az ún. kis-rostos idegi neuropátiák aluldiagnosztizálva maradnak. Friss 2021-ben megjelent szakcikk a B6 neuropátiát okozó hatásának lehetséges okait és az ezzel kapcsolatos szakirodalmat tekintette át. [1] A lehetséges okok közt szerepel a PLP magas szintje, azonban a legvalószínűbb okaként a szövetek PN/PL arányát határozták meg. Mega dózisban szedve a PN ugyanis már nem lesz képes mind maradéktalanul átalakulni PL-é és perifériás szövetekben ez esetleg gátolhatja a B6-vitamin hatást. Egy részben ennek megállapítására rendezett humán klinikai vizsgálatban [1, kép] a piridoxin-hidroklorid (PN-HCl) napi 25mg-os szedése esetén az alanyok véréből csak PL-t és PLP-t tudtak mérni, mivel ezek szintjét emelte csak a szedett PN. PN és PNP-t semennyi nem volt mérhető a vérükben, azaz biztosan az összes PN átalakult PL-é. Ugyan ebben a vizsgálatban napi 100mg dózis bár még nem okozott neuropátiás zavarokat, a vérben már átalakulatlan PN-t tudtak mérni, azaz napi 100mg PN már megterheli az átalakulási folyamatokat (legalábbis B2-vitamin pótlása nélkül, hiszen az alanyok azt nem kaptak a B6 mellett szimultán) és már elkezdheti eltolni a PN/PL arányt.
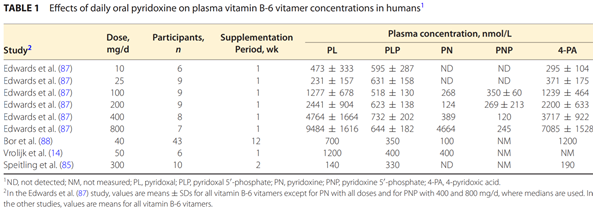
Bárhogy is, 25mg-ig tökéletesen átalakult a PN PLP-vé és PL-é emberekben, azaz ideális arány tartása mellett emelte meg a szinteket, még B2 külön pótlása nélkül is. A B2-vitamin a legfontosabb faktor, a szűk keresztmetszet a PN PLP-vé alakításában és ráadásul egy vizsgálatban[2] embereken növelte a B2-vitamin pótlása a PLP szintet, B6 pótlása nélkül is, így biztosak lehetünk benne, hogy javítani fogja a PN/PL arányt, megelőzve ezzel a neuropátia vélt okát.[1,2] Amíg több ki nem derül a témában a jövőbeli vizsgálatokból, addig a biztonság kedvéért érdemes a B6-vitamint PN és PLP formák keverékeként magunkhoz venni, megfelelő B2 bevitel mellett. Így, ha olyan egészségügyi problémánk vagy hiányállapotunk lenne, mely eredményeként nincs elég enzimünk a PLP hasznosulásához, akkor is a piridoxin HCl-ből felszabaduló szabad PN hasznosulni fog tudni, míg a PLP-ből is jó eséllyel felszabadul szabad PL. Ahogy említettem, a PL HCl sójának (piridoxal-HCl) használata áthidalná a problémát (EU-ban nem engedélyezett és világszinten sem ismerek példát e forma alkalmazására kiegészítőkben), azonban feltehetően ennek a formának az egyoldalú használata, ahogy a PLP egyoldaló használata is más problémákhoz vezetne, ugyanis szervezetünk sejtjei számára ugyan jellemzően a PLP a fontos végső forma, ami létrejön bennük, de sok sejtünknek kifejezetten piridoxinra (PN) van szüksége.[1] Emiatt egyoldalúan csak a piridoxal formák (PL és PLP) biztosítása szintén aggályos lehet. Élelmiszereinkben is vegyesen fordul elő a PL, PN és PM forma (foszfoészter formáikat, pl PLP, azért nem említem, mert azok úgyis csak akkor tudnak hasznosulni, ha előtte az említett szabad formáikra tudtak emésztődni/alakulni). A természetességre/életszerűségre való törekvés meg mindig jó irány, még ha picit romantikus megközelítés is, egyben tudományos is, hiszen evolúció alapú. Vakon nem, de iránymutatónak jó. Emiatt is a PLP és PN formák vegyes pótlása tűnik ideálisnak, bár ezt ne tekintsük tudományos érvnek.
További részletekbe nem bocsátkozva most, a meglátásom szerint nagyjából fele-fele arányban lehet érdemes a piridoxin-HCl és piridoxal-5-formákból pótolni a B6-ot, de a lényeg, hogy legalább 5mg legyen egyikből és másikból is és a kettő együtt a 25mg-ot ne lépje túl + megfelelő B2 bevitelünk is legyen, azaz legalább 5mg B2 bevitel /nap, bár a biztonság kedvéért inkább 10-20mg közt lehet érdemes a B2-t, ha 25mg-ot megközelíti vagy meghaladja a PN pótlás mennyisége.
Összegezve: A PLP és piridoxin hidroklorid pótlás is tökéletesen megfelelő az emberek nagy többsége vagy akár egésze számára, amennyiben nincs B2-vitamin hiányuk. 25mg napi B6 pótlásának túllépése nem csak felesleges és életszerűtlen, de a neuropátia kockázatát is növeli, ami bár napi 100mg-ig elenyésző. A nagy dózisban (>25mg) való B6-vitamin pótlás feltehetően biztonságosabb, ha B2 is pótolva van és a B6-nak max.25mg-ja származik csak PN-ből, az e feletti rész PLP-ből. Kis dózisú (<25mg) B6 pótlás esetén pedig biztosabb hatású, ha vegyes formában pótoljuk és nem csak az egyiket vagy másikat. Mindez azonban az emberek csak töredékét érinti, a többség számára mind egyformán jó, amíg nincs B2 hiány.
Felhasznált szakirodalom
(A bennük lévő releváns szöveget is mutatjuk, akit érdekel és nem szeretné végig bogarászni őket)
1. Hadtstein, F., & Vrolijk, M. (2021). Vitamin B-6-Induced Neuropathy: Exploring the Mechanisms of Pyridoxine Toxicity. Advances in nutrition (Bethesda, Md.), 12(5), 1911–1929. https://doi.org/10.1093/advances/nmab033
2. Marashly, E. T., & Bohlega, S. A. (2017). Riboflavin Has Neuroprotective Potential: Focus on Parkinson’s Disease and Migraine. Frontiers in neurology, 8, 333. https://doi.org/10.3389/fneur.2017.00333
3. Yoshii, K., Hosomi, K., Sawane, K., & Kunisawa, J. (2019). Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity. Frontiers in nutrition, 6, 48. https://doi.org/10.3389/fnut.2019.00048
4. Merrill AH Jr, Henderson JM. Vitamin B6 metabolism by human liver. Ann N Y Acad Sci. 1990;585:110-117. doi:10.1111/j.1749-6632.1990.tb28047.x
5. Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Foods (AFC) on a request from the Commission on Pyridoxal-5’-phosphate as a source for vitamin B6 added for nutritional purposes in food supplements. The EFSA Journal (2008) 760, 1-13.
Link: https://efsa.onlinelibrary.wiley.com/doi/pdf/10.2903/j.efsa.2008.760
