Bíró Szabolcs állításából ezt szűrheti le az olvasó:
A B6-vitamin pótlás egyetlen megfelelő formája a piridoxal-5-foszfát (PLP), a többi forma kerülendő.
Bíró Szabolcs indoklása:
Arra, hogy miért egyedül a PLP forma lenne jó és miért kerülendő a többi, nincs semmiféle indoklás, csak többször ki van emelve. Azonban arra, hogy miért a PLP a preferált B6 forma, van indoklás és referencia is. Az indoklás szerint a PLP már a kész „aktív” koenzim formája a B6-vitaminnak, így annak már nem kell átalakulnia, az biztosan felszívódik, míg a többi formának egy vagy két lépésben még át kell alakulnia PLP-vé. Az említett referencia, ami meg van adva a könyvben, egy 1990-ben megjelent szakcikk,[4] amely azonban világosan leírja ennek az ellenkezőjét. Azt, hogy a PLP-nek előbb piridoxálra (PL) kell bomlania, hogy felszívódhasson, majd később az alakul vissza PLP-vé, tehát minimum két lépésre van szüksége a szájon át bevett PLP-nek, amíg sejten belüli PLP-vé válik és nem képes közvetlenül felszívódni. Hátrányban van az egyszerű szabad formákkal szemben, nem előnyben. A referenciának megadott szakcikkben le van írva az is, hogy milyen lépések mennek végbe a májban, míg a B6-vitamin a különböző formáiból PLP-vé alakul. Ez a Vitaminipar könyvben úgy van kommunikálva, mintha a szájon át bevett B6-vitamin lépéseire vonatkozna és ebből jut a könyv arra a következtetésre, hogy a B6 pótlásnak a PLP a preferált módja. Majd később érthetetlen okokból végül azt a végkövetkeztetést vonja le, hogy a PLP az egyetlen megfelelő módja a B6-vitamin pótlásnak és a többi forma kerülendő. A megadott referenciában azt is írják, hogy 25 mg piridoxin (PN) kiegészítés normalizálta a B6-vitamin hiányt, és növelte a PLP szintjét, még súlyos májkárosodás (májcirrózis) esetén is, azaz remekül átalakult a PN PLP-vé.
Az én állításom:
A legmegfelelőbb módja a B6-vitamin pótlásának, ha vegyesen pótoljuk a piridoxal-5-foszfát (PLP) és a piridoxin-hidroklorid (PN-HCl) formát, azonban 25mg-ot meg nem haladó összmennyiségben. B2-vitamin megfelelő ellátottsága esetén feltehetően semmi előnye a PLP formának a PN-HCl felett, sőt még hátránya is lehet. B2-vitamin hiány esetében valóban egyértelműen a PLP forma a jobb, sőt olyankor csak az a jó, azonban ez nem ok a PLP preferálására, hiszen a legtöbb multivitamin/b-komplex bőven elég B2-t tartalmaz a B6 mellett. Létezik azonban még egy ok, ami miatt pusztán elővigyázatosságból, de fontosnak tartom, hogy PLP forma is jelen legyen a PN forma mellett, méghozzá jelentős mennyiségben, ahogyan arra is van legalább két ok, hogy ne csak PLP formába pótoljuk a B6-ot (ezekről bővebben az indoklásomban). Összességében az emberek nagy többsége számára mindkét forma tökéletes. a PLP és PN-HCl is (25mg-ig), de létezhetnek esetek, amikor a vegyes pótlásuk megfelelőbb, így általánosságban is vegyesen érdemes termékekbe integrálni a B6-ot, 25mg-ot meg nem haladó napi dózisban.
Az én indoklásom:
Élelmiszerekben a B6-vitamin 7 féle formában fordul elő: Piridoxin (PN), piridoxal (PL) és piridoxamin (PM) formájában, illetve ezek foszfoészter formáiban, azaz piridoxin-5-foszfát (PNP), piridoxal-5-foszfát (PLP) és piridoxamin-foszfát (PMP) formában, illetve előfordul még piridoxinsav (4-PA) formájában is. [1] Ezek mind PLP-vé alakulnak a sejtekben és „aktív” foszfoészter formáikban egyik sem tud felszívódni. [1,3,4,5] Állati élelmiszerekben főleg PL, PLP és 4-PA formában található, míg növényi élelmiszerekre mind a 7 forma jellemző. [3,5]
Étrend-kiegészítőkben az EU-ban csak a piridoxin és piridoxal használható. Előbbi só formájában (piridoxin-HCl, azaz PN-HCl) és foszfoészter formájában is (piridoxin-5-foszfát, azaz PNP) használható, míg utóbbi csak a foszfoészter formájában (piridoxal-5-foszfát, azaz PLP), ami mellesleg a sejten belüli aktív koenzim forma maga.
Legyen az élelmiszer vagy kiegészítő, a bevett foszfoészter formáknak (pl PLP) először át kell alakulniuk PN-é, PL-é vagy PM-vé, hogy fel tudjanak szívódni, sőt még utána, a sejtek is csak ezen egyszerű formáikban képesek őket felvenni jellemzően. Végül a sejtekben alakulnak át a végső aktív konenzim formáikká, PLP-vé. [1,2,3,4,5] Tehát, ahogy a B1, B2, B3, B5 esetében is láthattuk, itt is, bár az élelmi források is jellemzően a már aktív formáikat tartalmazzák, a hasznosulásuk csak a visszabontott legegyszerűbb formában tud megtörténi és a sejtekbe bejutva, ott épülnek föl belőlük az aktív koenzim formáik. Hiába szedjük be tehát a már aktív formáikat, azok csak 1 lépéssel hátrább vannak a végső céljuktól, a végső sejten belül aktív koenzimformává való alakulásuktól, hiába már maguk is azok… Ezzel szemben a só formáik, ahogy minden só, azonnal disszociálnak bármilyen folyadékban (pl. gyomrunkban lévő folyadékban) és szétesnek ionjaikra, azaz a már eleve felszívódni képes szabad formájukra. Ezért van minden sima, nem aktív B-vitamin forma legalább 1 lépéssel előrébb a már kész formáikhoz képest, mert ezeknek már nem kell előbb visszaalakulniuk, így éppen hogy ezek szívódnak fel biztosan, míg az aktív formáik bizonyos egészségügyi problémák, hiányállapotok esetén fellépő enzimhiányok miatt nem képesek megfelelően felszívódni (bővebben erről az előző B1, B2, B5 írásaimban). Bár a marketinganyagok az ellenkezőjével próbálják megvezetni a laikusokat, a szakirodalomban teljes a konszenzus ezen a téren: Az aktív koenzim B1/2/3/5/6 formák orális szedése 1 lépéssel hátrébb és nem előrébb van, mint a sima szabad/só formáik használata.
A B6-vitamin azonban részben kivétel a B-vitaminok közül ezen a téren (a B9-hez hasonlóan), itt ugyanis nem csak hátránnyal jár a már kész aktív forma használata, de előnnyel is. Miért?
A végső forma, amivé a sejtjeinkben alakulnia kell a bármiből származó B6-nak, a PLP. Nézzük végig, hogy melyik forma hogyan alakul végül PLP-vé… Ez történik velük a szájon át való elfogyasztásuk során (a piridoxamint és foszfoészterét, illetve a piridoxinsavat kihagyom a felsorolásból, mert kevéssé érinti a témát + ugyan az történik velük is, mint a többivel, melyek itt lényegesebbek):
Piridoxin (PN) A pridixin HCl sója lenyelés után a gyomorban azonnal szabad piridoxinná alakul, majd felszívódik a vékonybélben. Végül akár még a vékonybél sejtjeiben, akár a májban, akár más sejtekben átalakul piridoxin-5-foszfáttá (PNP) a piridoxin-kináz enzim révén, majd piridoxal-5-foszfáttá (PLP) a B2-vitamin függő PNPO enzim által. [1,2,3,4,5] Ez utóbbi átalakulás jellemzően a májban történik, ha magas a dózis.[4] A májból kikerült PLP a végső célsejtekbe való bejutás előtt lebomlik szabad piridoxállá (PL), majd visszaalakul PLP-vé bennük, szintén a PNPO enzim segítségével.[4]
A piridoxin-5-foszfát (PNP) 1 lépéssel nem előrébb, hanem hátrébb van ehhez képest (ellenkezőleg, mint ahogy a Vitaminipar című szerepel). Először ugyanis a PNP-nek szabad piridoxinná (PN) kell alakulni a vékonybélben, hogy ott felszívódhasson.[1,4,5] Miután PN-é alakult, onnantól kezdve nyilván ugyanaz lesz az átalakulásának és célsejtekbe jutásának folyamata, mint amit fentebb a PN esetében leírtam.
Piridoxal (PL) lenyelés után felszívódik, eljut a sejtekhez, ahol a piridoxin-kináz enzim révén PLP-vé alakul,[1,2,4] azaz ez valóban 1 lépéssel előrébb lenne a többinél, miközben hátránya semmilyen téren nem lenne, csak sajnos az EU-ban tiltott + nem ismerek a világon egyetlen terméket sem, ahol használnák, pedig létező alapanyag a piridoxal sója (piridoxal-hidroklorid), mely azonnal piridoxallá esik szét a gyomorban.
Piridoxal-5-foszfát (PLP) Először a vékonybelünkben lévő enzimeknek le kell bontania szabad PL-é, hogy felszívódhasson, majd a PL eljut a sejtekbe, ahol PLP-vé alakul, ahogy PL-nél leírtam. Ez tehát egyszerre van 1 lépéssel előrébb és 1lépéssel hátrébb, mint pl a piridoxin-hidroklorid, de 1lépéssel előrébb, mint a piridoxin-5-foszfát (PNP). [1-5]
Egy egyszerűsített kép a különböző formák enzimatikus átalakulásáról:[2]
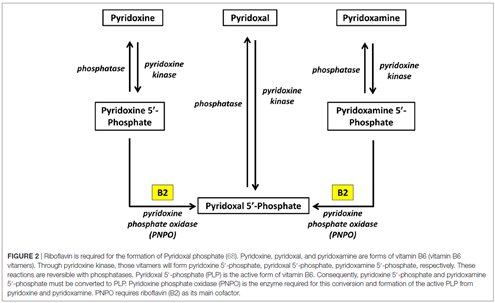
Láthatjuk tehát, hogy a PN (pl PN-HCl) annyival van előrébb a PLP-hez képest, hogy már egyből a B6 szabad formáját biztosítja, így az biztosan felszívódik, akkor is, ha nincs elég alkaikus-foszfatáz és egyéb enzim a bélben/vérben/stb, míg a PLP csak akkor tud hasznosulni, ha van elég ilyen enzim, amik lehasítják róla a foszfát-csoportot.[5] Miközben a PLP meg annyival van előrébb, hogy neki már nem kell átalakulnia a B2-vitamin függő PNPO enzim által PL-é, de ugyan úgy át kell alakulni a PLP-nek is PL-é majd vissza PLP-vé a piridoxin-kináz enzim által, ahogy a PN-nek is. [1-5] Összefoglalva tehát a PLP is 1 lépés hátrányban és 1 lépés előnyben van a piridoxin HCl-hez képest és fordítva is ez igaz. A piridoxin-hidroklorid előnye, hogy ő biztosan felszívódik, enzim készleteinktől és egészségi állapotunktól függetlenül, míg a PLP előnye, hogy neki nincs szüksége a B2 függő PNPO enzimre. Ez jellemzően annyit jelent, hogy B2 hiányban van előnye a PLP-ként való B6 pótlásnak, míg B2 megfelelő bevitele mellett a piridoxin-hidroklorid tűnik előnyösebbnek (és olcsóbb is) a PLP-nél.
Bár az EU-ban nem engedélyezett, létezik piridoxal-hidroklorid formája is a B6-nak, ez lenne a jobb, mint a PLP, ugyanis ez már szabad formáva alakul azonnal oldódáskor, azaz ehhez kell a legkevesebb enzim/átalakulás (sem foszfatáz enzimekre nincs szükség a felszívódásához, sem PNPO enzimre az átalakulásához. Csak a piridoxin-kináz szükséges hozzá a sejteken belül, ami viszont az összes formához szükséges). A legideálisabb a piridoxal-HCl és piridoxin HCl formák keveréke lenne.
Ha megfelelő B2 bevitel mellett a sima piridoxin is átalakul piridoxállá és olcsóbb is, mint a PLP, ami ráadásul bizonyos állapotokban fel sem szívódik, akkor mi értelme van mégis PLP forma használatának?
A B6-vitamin extrém nagy dózisainak hosszú távú használata esetén (500mg feletti napi dózisok esetén) észrevették ún. neuropátiás zavarok megjelenését, mely a végtagok érzékelésében bekövetkezett változásként jelent meg, pl zsibbadás vagy csökkent érzékelés, mint tünet. Ezek a tünetetek a nagy dózisú B6 szedésének abbahagyásával megszűntek. 100-500mg közti napi dózisok éveken át szedve sem okoztak semmiféle problémát vizsgálatokban, azonban léteznek esettanulmányok, ahol már 100mg-os vagy alatti B6 dózisok is ilyen átmeneti, enyhe neuropátiás zavarokat váltottak ki. Fontos megjegyezni, hogy nagyon ritkán megjelenő problémáról van szó, alig pár eset ismert, miközben emberek milliói szedik nagy dózisban a B6-ot. Azonban nem kizárható, hogy az ún. kis-rostos idegi neuropátiák aluldiagnosztizálva maradnak. Friss 2021-ben megjelent szakcikk a B6 neuropátiát okozó hatásának lehetséges okait és az ezzel kapcsolatos szakirodalmat tekintette át. [1] A lehetséges okok közt szerepel a PLP magas szintje, azonban a legvalószínűbb okaként a szövetek PN/PL arányát határozták meg. Mega dózisban szedve a PN ugyanis már nem lesz képes mind maradéktalanul átalakulni PL-é és perifériás szövetekben ez esetleg gátolhatja a B6-vitamin hatást. Egy részben ennek megállapítására rendezett humán klinikai vizsgálatban [1, kép] a piridoxin-hidroklorid (PN-HCl) napi 25mg-os szedése esetén az alanyok véréből csak PL-t és PLP-t tudtak mérni, mivel ezek szintjét emelte csak a szedett PN. PN és PNP-t semennyi nem volt mérhető a vérükben, azaz biztosan az összes PN átalakult PL-é. Ugyan ebben a vizsgálatban napi 100mg dózis bár még nem okozott neuropátiás zavarokat, a vérben már átalakulatlan PN-t tudtak mérni, azaz napi 100mg PN már megterheli az átalakulási folyamatokat (legalábbis B2-vitamin pótlása nélkül, hiszen az alanyok azt nem kaptak a B6 mellett szimultán) és már elkezdheti eltolni a PN/PL arányt.
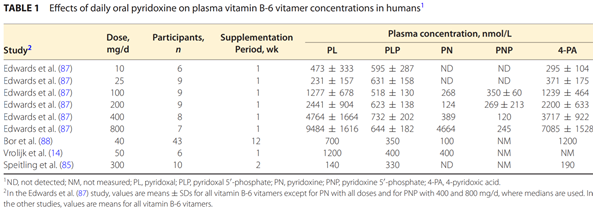
Bárhogy is, 25mg-ig tökéletesen átalakult a PN PLP-vé és PL-é emberekben, azaz ideális arány tartása mellett emelte meg a szinteket, még B2 külön pótlása nélkül is. A B2-vitamin a legfontosabb faktor, a szűk keresztmetszet a PN PLP-vé alakításában és ráadásul egy vizsgálatban[2] embereken növelte a B2-vitamin pótlása a PLP szintet, B6 pótlása nélkül is, így biztosak lehetünk benne, hogy javítani fogja a PN/PL arányt, megelőzve ezzel a neuropátia vélt okát.[1,2] Amíg több ki nem derül a témában a jövőbeli vizsgálatokból, addig a biztonság kedvéért érdemes a B6-vitamint PN és PLP formák keverékeként magunkhoz venni, megfelelő B2 bevitel mellett. Így, ha olyan egészségügyi problémánk vagy hiányállapotunk lenne, mely eredményeként nincs elég enzimünk a PLP hasznosulásához, akkor is a piridoxin HCl-ből felszabaduló szabad PN hasznosulni fog tudni, míg a PLP-ből is jó eséllyel felszabadul szabad PL. Ahogy említettem, a PL HCl sójának (piridoxal-HCl) használata áthidalná a problémát (EU-ban nem engedélyezett és világszinten sem ismerek példát e forma alkalmazására kiegészítőkben), azonban feltehetően ennek a formának az egyoldalú használata, ahogy a PLP egyoldaló használata is más problémákhoz vezetne, ugyanis szervezetünk sejtjei számára ugyan jellemzően a PLP a fontos végső forma, ami létrejön bennük, de sok sejtünknek kifejezetten piridoxinra (PN) van szüksége.[1] Emiatt egyoldalúan csak a piridoxal formák (PL és PLP) biztosítása szintén aggályos lehet. Élelmiszereinkben is vegyesen fordul elő a PL, PN és PM forma (foszfoészter formáikat, pl PLP, azért nem említem, mert azok úgyis csak akkor tudnak hasznosulni, ha előtte az említett szabad formáikra tudtak emésztődni/alakulni). A természetességre/életszerűségre való törekvés meg mindig jó irány, még ha picit romantikus megközelítés is, egyben tudományos is, hiszen evolúció alapú. Vakon nem, de iránymutatónak jó. Emiatt is a PLP és PN formák vegyes pótlása tűnik ideálisnak, bár ezt ne tekintsük tudományos érvnek.
További részletekbe nem bocsátkozva most, a meglátásom szerint nagyjából fele-fele arányban lehet érdemes a piridoxin-HCl és piridoxal-5-formákból pótolni a B6-ot, de a lényeg, hogy legalább 5mg legyen egyikből és másikból is és a kettő együtt a 25mg-ot ne lépje túl + megfelelő B2 bevitelünk is legyen, azaz legalább 5mg B2 bevitel /nap, bár a biztonság kedvéért inkább 10-20mg közt lehet érdemes a B2-t, ha 25mg-ot megközelíti vagy meghaladja a PN pótlás mennyisége.
Összegezve: A PLP és piridoxin hidroklorid pótlás is tökéletesen megfelelő az emberek nagy többsége vagy akár egésze számára, amennyiben nincs B2-vitamin hiányuk. 25mg napi B6 pótlásának túllépése nem csak felesleges és életszerűtlen, de a neuropátia kockázatát is növeli, ami bár napi 100mg-ig elenyésző. A nagy dózisban (>25mg) való B6-vitamin pótlás feltehetően biztonságosabb, ha B2 is pótolva van és a B6-nak max.25mg-ja származik csak PN-ből, az e feletti rész PLP-ből. Kis dózisú (<25mg) B6 pótlás esetén pedig biztosabb hatású, ha vegyes formában pótoljuk és nem csak az egyiket vagy másikat. Mindez azonban az emberek csak töredékét érinti, a többség számára mind egyformán jó, amíg nincs B2 hiány.
Felhasznált szakirodalom
(A bennük lévő releváns szöveget is mutatjuk, akit érdekel és nem szeretné végig bogarászni őket)
1. Hadtstein, F., & Vrolijk, M. (2021). Vitamin B-6-Induced Neuropathy: Exploring the Mechanisms of Pyridoxine Toxicity. Advances in nutrition (Bethesda, Md.), 12(5), 1911–1929. https://doi.org/10.1093/advances/nmab033
Metabolism In humans, the major forms of vitamin B-6 include PN, PM, PL, their phosphorylated derivatives, and the metabolic end product 4-pyridoxic acid (4-PA). All forms of vitamin B6 are present in food sources and are converted into PLP by the “B-6 salvage pathway” shown in Figure 1. Under normal dietary circumstances, the majority of absorbed PN and PM are converted into PLP and released as PL in the small intestine. With normal vitamin B-6 intake, there are negligible amounts of PN and PM in the portal vein and/or circulation (21–23). With higher doses, the liver is the primary site of PN metabolism (24, 25). In the blood, vitamin B-6 is present primarily as PLP and to a lesser extent as PL and 4-PA (26). Vitamin B-6 metabolism in humans has been discussed in greater detail in reviews by Parra et al. (27), Coburn (26) and EFSA (3). Recently, PL/PLP reductase activity was identified in humans. PLP-treated patients had increased PN concentrations in plasma and cerebrospinal fluid. The reduction of PL to PN has been observed in a large variety of mammalian cell types. This PL reductase activity is likely more important under conditions of high PL and/or unbound PLP concentrations (28).
Dose–response relation. The minimum dose and treatment duration necessary to elicit neuropathy has not been firmly established (6). While many isolated case reports describe neuropathy in patients taking PN at doses well below 500 mg/d, PN toxicity at these doses may not be fully supported by the controlled studies. Multiple controlled studies found that PN doses of 100–500 mg/d were well tolerated; however, the duration of treatment was likely too short to assess neurological effects (6). Additional studies found that PN doses of 200– 500 mg/d taken for several years did not lead to neurological symptoms. Mitwalli et al. (52) found that PN doses of 250–500 mg/d for 8 mo to 6 y produced no neurological effects in 22 patients treated for hyperoxaluria (52). Another study found that PN doses of 200–500 mg/d administered from birth for 7–24 y were well tolerated in 17 patients treated for homocystinuria (53). However, these studies may not be applicable to the general population because of possible interactions with the underlying health conditions. Furthermore, these observational studies were not subject to double-blind, placebo-controlled evaluation, and were limited by insufficient monitoring of PN intake, small group size, and inadequate assessment of adverse effects (6). A number of more recent case reports have described symptoms of neuropathy in people taking PN at doses near or even below the EFSA UL of 25 mg/d. In 2005, de Kruijk and Notermans (54) reported on 2 patients who developed symptoms of sensory neuropathy after takingPN doses of 24 and 40 mg/d, who recovered following discontinuation. Another case report, involving a patient who self-administered 30 mg PN/d, confirmed a case of sensory ataxic ganglionopathy using electrophysiological studies. However, in this case, high consumption of PNcontaining energy drinks may have been a contributing factor (55). Additionally, from 1991 until July 2017, the Netherlands Pharmacovigilance Centre Lareb received 90 reports of vitamin B-6-related neuropathy with doses ranging from 1.4 to 100 mg/tablet (14, 15). The most common symptoms involved numbness and paresthesia, which is consistent with the early symptoms described in previous case reports. In 82 of the cases, there was an observed latency in response. In 30 cases, symptoms diminished following discontinuation; however, in 29 cases, symptoms did not improve. A major limitation of this case series was the lack of information on PN intake. Vitamin B-6 content in products and whether the patient took more than the advised dosage could not be verified. Plasma vitamin B-6 concentrations were known in only 36 cases and dosage was only known in 37 cases. Given the inherent limitations of isolated case reports, it is not possible to infer a causal relation at these low doses (15).
Conclusions In summary, despite the fact that the number of case reports describing neuropathic symptoms in patients taking PN is increasing, the mechanisms behind PN toxicity are not yet known. Previously proposed mechanisms include aldehyde toxicity by PLP, the formation of quinone methide-type intermediates, competitive inhibition of PLPdependent enzymes, and PDXK inhibition. For several reasons, we conclude that PDXK inhibition and consequently disrupted GABA neurotransmission is the more plausible hypothesis. Genetic deficiencies in PDXK lead to the development of axonal sensory neuropathy. The neurotoxic effect of reduced PDXK activity is contingent on PLP depletion. PN has a higher affinity toward PDXK compared with its other substrates and likely acts as a competitive inhibitor of the enzyme. The degree of PDXK inhibition therefore depends on the ratio of PL to PN. Generally, PL concentrations are much higher than PN in most tissues. Tissues with comparatively low PNPO activity and high PL reductase and oxidase activity are more likely to have a low PL:PN. In these tissues, PLP biosynthesis is likely reduced as with a PDXK deficiency. There are, for instance, indications that the testes have low PNPO activity and elevated PL reductase/oxidase activity. The testes are therefore susceptible to PN toxicity. Future investigations are needed to examine the relation between PL:PN and PN toxicity in testicular tissue. There is a paucity of information related to relative gene and protein expression in sensory neurons; however, there is evidence for high AKR activity. Presently, there is insufficient information to infer a mechanistic link between PDXK inhibition and toxicity. PDXK inhibition likely has a number of pleiotropic effects. Mutations in vitamin B-6 metabolic enzymes consistently have an impact on GABA activity. Additionally, compounds that inhibit PDXK lead to reductions in GABA biosynthesisTherefore, PDXK-induced neuropathy is most likely related to GABA activity. While no direct evidence exists in DRG neurons, GABA inhibition may lead to excitotoxicity and neurodegeneration. More investigations are needed to test the effects of PN, PDXK, and GABA inhibition on sensory neurons.
2. Marashly, E. T., & Bohlega, S. A. (2017). Riboflavin Has Neuroprotective Potential: Focus on Parkinson’s Disease and Migraine. Frontiers in neurology, 8, 333. https://doi.org/10.3389/fneur.2017.00333
Pyridoxal phosphate is the active form of pyridoxine. Pyridoxine phosphate oxidase (PNPO) synthesizing PLP requires riboflavin as its main cofactor (65). In fact, conditioned pyridoxine deficiency can arise from riboflavin deficiency (66). Administration of low dose riboflavin to individuals with decreased EGRAC or PLP levels has significantly enhanced the status of the decreased nutrient whether its riboflavin or PLP (67). Consequently, riboflavin is considered the limiting nutrient (67) (Figure 2).
3. Yoshii, K., Hosomi, K., Sawane, K., & Kunisawa, J. (2019). Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity. Frontiers in nutrition, 6, 48. https://doi.org/10.3389/fnut.2019.00048
Vitamin B6 exists in several forms, including as pyridoxine, pyridoxal, and pyridoxamine. These forms of vitamin B6 are precursors of the coenzymes pyridoxal phosphate (PLP) and pyridoxamine phosphate (PMP), which are involved in a variety of cellular metabolic processes, including amino acid, lipid, and carbohydrate metabolism (81). WHO/FAO recommends a daily vitamin B6 intake of 1.3–1.7 mg for adults (16). Vitamin B6 deficiency is associated with the development of inflammatory diseases such as allergy and rheumatoid arthritis, as well as with neuronal dysfunction (82–84). Vitamin B6 deficiency disrupts the Th1–Th2 balance toward an excessive Th2 response, resulting in allergy (85). Moreover, low plasma vitamin B6 levels, together with increased levels of pro-inflammatory cytokines such as TNF-α and IL-6, have been observed in patients with rheumatoid arthritis (86). However, the mechanism underlying the regulation of inflammation by vitamin B6 is currently unknown. Vitamin B6 contributes to intestinal immune regulation through the metabolism of the lipid mediator sphingosine 1-phosphate (S1P). S1P regulates lymphocyte trafficking into the intestines, especially in the large intestine. Lymphocyte trafficking is dependent on S1P gradient which is created by S1P production and its degradation. S1P degradation is mediated by S1P lyase that requires vitamin B6 as a cofactor. The administration of vitamin B6 antagonist impairs S1P lyase activity and creates an inappropriate S1P gradient, resulted in impairing lymphocyte migration from lymphoid tissues and reducing the numbers of lymphocytes in the intestines (87). The lymphocytes located between gut epithelial cells are known as intraepithelial cells (IELs) which are involved in the protection against pathogens (88). Therefore, vitamin B6 is important role for immunosurveillance in the intestines.
Vitamin B6 is abundant in fish, chicken, tofu, sweet potato, and avocado. Dietary vitamin B6 exists as PLP or PMP; it is converted to free vitamin B6 by endogenous enzymes such as pyridoxal phosphatase and is then absorbed by the small intestine. Although absorption of vitamin B6 through acidic pH-dependent and carrier-mediated transport has been shown, an intestinal pyridoxine transporter is yet to be identified in any mammalian species (11). After the absorption of free vitamin B6, it enters the blood and is converted back to PLP or PMP.
Microbial vitamin B6 is synthesized as PLP from deoxyxylulose 5-phosphate and 4-phosphohydroxy-L-threonine or from glyceraldehyde-3-phosphate and d-ribulose 5-phosphate (10). In the large intestine, bacteria-derived PLP is converted to free vitamin B6, which is absorbed by passive transport, transported to the blood, and distributed throughout the body.
Metagenomic analysis has shown that Bacteroides fragilis and Prevotella copri (Bacteroidetes), Bifidobacterium longum and, Collinsella aerofaciens (Actinobacteria), and Helicobacter pylori (Proteobacteria) possess a vitamin B6 biosynthesis pathway. Bacteroidetes and Proteobacteria likely produce vitamin B6 starting from deoxyxylulose 5-phosphate and 4-phosphohydroxy-l-threonine, whereas Actinobacteria likely start from glyceraldehyde-3-phosphate and d-ribulose 5-phosphate. In contrast, most Firmicutes genera (Veillonella, Ruminococcus, Faecalibacterium, and Lactobacillus spp.), except for some Clostridium (C. bartlettii, C. leptum, C. methylpentosum, and C. sporogenes) and Lactobacillus spp. (L. brevis and L. ruminis) lack a vitamin B6 biosynthesis pathway (10) (Table 1).
4. Merrill AH Jr, Henderson JM. Vitamin B6 metabolism by human liver. Ann N Y Acad Sci. 1990;585:110-117. doi:10.1111/j.1749-6632.1990.tb28047.x
The vitamin B, group is composed of three natural compounds-pyridoxine (pyridoxol, PN), pyridoxamine (PM), and pyridoxal (PL).’ Pyridoxine is encountered in foods in the free form and as the glycoside,2 which is partially hydrolyzed in the intestine (the glycoside can also be absorbed); PL and PM are present primarily as the 5’-phosphates, which are hydrolyzed by intestinal phosphatases. The three vitamers are absorbed in the jejunum (which involves metabolic trapping by phosphorylation)’ and cross the basolateral membrane to enter circulation in mainly the nonphosphorylated forms.’ Once in blood, PL is bound by albumin,’ and PN and PL are taken up by erythrocytes, where some PN can be converted to PL and bound by hemoglobin.’ A substantial portion of the absorbed vitamin B, is transported to liver and, in the unphosphorylated forms, enter the hepatocytes by diffusion followed by metabolic trapping.’.’’ The various aspects of vitamin B, metabolism have been reviewed in depth,”-13 and most investigations have built on the elegant early findings of Snell and colleagues (for examples, see Refs. 14-16) (FIG. 1). After phosphorylation by a single kinase, the PNP and PMP are oxidized to PLP by an FMN-dependent oxidase,” and PLP is bound by apo-enzymes or released into plasma (as PLP or after hydrolysis).” The PLP is dephosphorylated by alkaline phosphatase before uptake by other tissues. Most of the PL in excess of tissue needs is oxidized to 4-PA, presumably by the liver and kidney. Because essentially all tissues have PL kinase, but few have significant amounts of the PNP(PMP) oxidase, it is thought that liver is responsible for converting dietary PN and PM to PL (via PLP) and that other tissues take up PL from circulation and convert it to PLP.
5. Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Foods (AFC) on a request from the Commission on Pyridoxal-5’-phosphate as a source for vitamin B6 added for nutritional purposes in food supplements. The EFSA Journal (2008) 760, 1-13.
Link: https://efsa.onlinelibrary.wiley.com/doi/pdf/10.2903/j.efsa.2008.760
The major forms of vitamin B6 from animal food products are pyridoxal and pyridoxal 5′-phosphate, whereas pyridoxine, pyridoxine 5′- phosphate, pyridoxamine and pyridoxamine 5′-phosphate are the main forms obtained from plants (Midttun et al., 2007)
As only dephosphorylated vitamers can be transported into the cells (Coburn et al., 2003) the bioavailability of intact pyridoxal 5’-phosphate upon oral intake would be low. Bioavailability of vitamin B6 from pyridoxal 5’-phosphate requires hydrolysis of the phosphate group before absorption through the intestinal layer may occur.
Removal of the phosphate group is a function of alkaline phosphatases, which are encoded by at least four different genes producing tissue non specific, intestinal, placental and germ cell alkaline phosphatases (van Hoof and De Broe, 1994). The tissue non-specific alkaline phosphatase is the one predominantly involved in vitamin B6 metabolism and it is located anchored to the ectoplasmic side of the plasma membrane. Given that the bioavailability of pyridoxal 5’-phosphate requires hydrolysis of the phosphate group before absorption through the intestinal layer may occur, one can conclude that the bioavailability of vitamin B6 from pyridoxal 5’-phosphate will be lower than or at best similar to the bioavailability of pyridoxine.
